- 上海中申国际贸易有限公司,20年外贸进出口代理服务经验。
- 服务热线:139 1787 2118
韩国医疗器械市场准入的流程相对复杂,涉及到多个步骤和多个部门的参与。本文将简单介绍一下医疗器械出口韩国需要的认证和注册流程。
主管部门
韩国食品药品管理局(MFDS)是韩国医疗器械的主管部门,负责食品,药品,医疗器械和化妆品的安全,食品和制药工业发展,以及促进公共健康。
医疗器械分类
韩国将医疗器械分为四类,即Ⅰ、Ⅱ、Ⅲ、Ⅳ类,这种分类方法与欧盟对医疗器械的分类方法非常相似。每一类器械都有不同的市场准入途径,基于医疗器械的风险分类,审批流程和时间也有所不同。
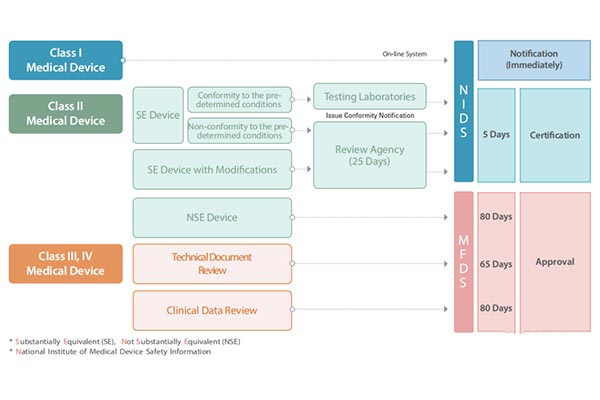
产品测试与临床试验
需要注册的产品样品可直接寄到韩国实验室测试,或在具有韩国相应资质的国内实验室进行测试,提供合格的测试报告。MFDS指定了一系列的测试实验室和临床试验的定点医院。
体系考核
出口到韩国的II,III,IV类医疗器械制造商都需要符合KGMP(Korean Good Manufacturing Practice)的要求,KGMP的要求与ISO 13485相类似。KGMP证书是颁发给进口商而不是生产商,证书每3年更新一次。
韩国化妆品证书申请网站:https://kcia.or.kr/cert/main/
韩国医疗器械注册流程
韩国进口医疗器械分为以下几个步骤:选择韩国持证人,产品注册,资料准备,产品检测,临床试验,产品注册证书,KGMP资料准备,医院准入。
产品上市以及上市后的监管
产品注册证以及KGMP证书颁发后,对于非家用医疗器械,还需要做医院的准入,进入医院的医保系统,取得医院医保号。此后,产品就可以正式在韩国市场销售了。产品上市后,MFDS有权跟踪一些指定的高风险医疗器械产品。对于在韩国市场出现不良反应的产品应及时召回。
最后,国外产品要进入韩国市场的条件有:需要准备非常详细的产品技术文档和申请韩国KGMP需要的资料;公司的体系要符合ISO 13485的要求;产品要符合标准要求。以上就是韩国医疗器械准入的相关制度,希望对医疗器械的进出口企业有所帮助。
最初发布于2023年6月30日 @ 14:14
相关推荐
联系我们
邮箱:service@sh-zhongshen.com
相关推荐
微信联系

? 2024. All Rights Reserved. 沪ICP备2023007705号-2  沪公网安备31011502009912号
沪公网安备31011502009912号